您现在的位置是: 首页 > 教育改革 教育改革
海南高考答案公布,海南高考试题及答案
tamoadmin 2024-05-28 人已围观
简介1.2010全国高考数学试题答案 海南2.2009海南省高考物理题第一大题,为什么求卡车刹车时的加速度3um=ma而不是2um-3um=ma,为什么没牵引力了3.跪求2008~2010海南高考全部真题理科的还有答案4.从哪儿找海南2007高考化学试题答案5.2008 海南化学高考的答案,有知道的说下高中地理合集百度网盘下载链接:提取码:1234简介:高中地理优质资料下载,包括:试题试卷、课件、教材
1.2010全国高考数学试题答案 海南
2.2009海南省高考物理题第一大题,为什么求卡车刹车时的加速度3um=ma而不是2um-3um=ma,为什么没牵引力了
3.跪求2008~2010海南高考全部真题理科的还有答案
4.从哪儿找海南2007高考化学试题答案
5.2008 海南化学高考的答案,有知道的说下

高中地理合集百度网盘下载
链接:提取码:1234
简介:高中地理优质资料下载,包括:试题试卷、课件、教材、视频、各大名师网校合集。
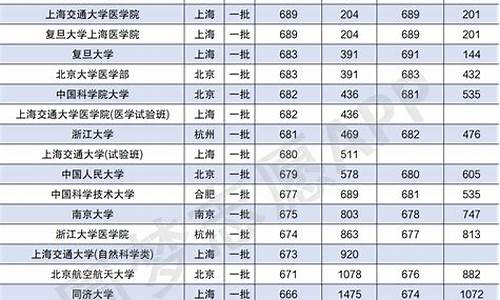
2010全国高考数学试题答案 海南
(08年海南化学?25)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是 、 ;杂化轨道分别是 、 _;a分子的立体结构是 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、 晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式) 。
(4)Y与Z比较,电负性较大的 ,其+2价离子的核外电子排布式是 。
答案:(11分)(1)CH4 SiH4 sp3 sp3 正四面体 (2)分子 原子 (3)CO2
(4)C (5)Zn 1s22s22p63s23p63d10
解析:由“Y原子的L层p轨道中有2个电子”可知Y原子的电子排布式是1s22s22p2,为碳元素;由“Z与Y原子的价层电子数相同”可知Z与碳元素同主族,又因Z位于元素周期表的前四周期且核电荷数大于Y,所以Z可能为硅元素(14号)或锗元素(32号),若Z为锗元素,则四种元素的核电荷数之和大于51(因W的核电荷数比Z的还要大),即Z只能为硅元素;由“W原子的L层电子数与最外层电子数之比为4︰1”可知W的最外层电子数为2,由“d轨道中的电子数与最外层电子数之比为5︰1”可知d轨道中的电子数为10,所以W原子的电子排布式是1s22s22p63s23p63d104s2,即W为锌元素;又因四种元素的核电荷数之和为51,所以X元素的核电荷数为1,是氢元素。
2009海南省高考物理题第一大题,为什么求卡车刹车时的加速度3um=ma而不是2um-3um=ma,为什么没牵引力了
前面题目设了AH=BH=1,三角形ADH中,AH与DH垂直,且角ADH为60度,可算出DH长为三分之根号三,这样可求得m的值
由于PH分别与AH、BH垂直,AH=BH=1,由勾股定理可知PA=PB,因为AC垂直BD,故AB等于根号2,因角APB等于60度,所以三角形PAB为等边三角形PA=PB=AB=根号2
PA=根号2,AH=1,所以PH=1,由此可算出n的值
跪求2008~2010海南高考全部真题理科的还有答案
嘿嘿,楼主满有上进心的嘛。我刚高三毕业,放假几个月东西忘的不少了,好在这道题做了没十遍也有八遍了,以下给出详细解答;
整个物理过程分三个阶段:
1.脱节后,车厢从12m/s减速至0。
车厢做匀减速直线运动,a=2m/s方,所以该过程车厢向前前进了36m。(这个很简单的,你应该会。)
2.脱节后至卡车司机发现时有3s的时间,由题设车厢与卡车质量均为m:
由题目可知脱节前系统匀速,故牵引力F=2mgu,脱节后卡车阻力变为mgu,牵引力不变,为F=2mgu,故此时卡车合力向前为f=F-mgu=2mgu-mgu=mgu,由1
可知此时卡车的加速度为a=2m/s方,三秒后卡车速度为18m/s,故此过程卡车前进了45m。(简单的自己算)
3.司机刹车至卡车静止。
此时阻力为原来的3倍,即3mgu,所以加速度为6m/s方,此过程的初速度为18m/s,由此可得此过程卡车前进27m。(简单的自己算)
所以到卡车静止时两车相距27m+45m-36m=36m
答案就是36m了。
用电脑给你作答,语言叙述比较多,过程也不是很规范。但是物理过程给你分析的很清楚了。
以后有啥问题可以找我,我可以给你一些指导。
qq380708752
这题还有不明白的可以百度hi我。
从哪儿找海南2007高考化学试题答案
高中文理综合合集百度网盘下载
链接:提取码:1234
简介:高中文理综合优质资料下载,包括:试题试卷、课件、教材、视频、各大名师网校合集。
2008 海南化学高考的答案,有知道的说下
2007年海南高考化学试题
1.下列物质中,不含有硅酸盐的是( B )
(A)水玻璃 (B)硅芯片 (C)黏土 (D)普通水泥
2.下列原子序数所对应的元素组中,两者可形成离子键的是( B )
(A)1和17 (B)12和9 (C)14和6 (D)15和8
3.下列叙述正确的是( C )
(A)95 ℃纯水的pH<7,说明加热可导致水呈酸性
(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4
(C)0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
4.下列叙述正确的是( B )
(A)一定温度、压强下,气体体积由其分子的大小决定
(B)一定温度、压强下,气体体积由其物质的量的多少决定
(C)气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
(D)不同的气体,若体积不等,则它们所含的分子数一定不等
5.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是 C
(A)CH3CH2CH2CH3 (B)CH3CH(CH3)2 (C)CH3C(CH3)3 (D)(CH3)2CHCH2CH3
6.已知:(1)Zn(s)+1/2O2(g) = ZnO(s);DH =-348.3 kJ/mol (2)2Ag(s)+1/2O2(g) = Ag2O(s);DH =-31.0 kJ/mol 则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的DH等于(A )
(A)-317.3 kJ/mol (B)-379.3 kJ/mol (C)-332.8 kJ/mol (D)317.3 kJ/mol
7.下列实验现象的描述错误的是( A )
(A)氢气在氯气中燃烧生成绿色烟雾
(B)红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
(C)点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
(D)钠在空气中燃烧,发出**的火焰,生成淡**固体
8.下列溶液能与镁反应生成氢气的是( A )
(A)氯化铵溶液 (B)氢氧化钠溶液 (C)碳酸钾溶液 (D)饱和石灰水
9.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( D )
(A)②④⑤③① (B)③②④①⑤ (C)③④②⑤① (D)②④③⑤①
10.能正确表示下列反应的离子方程式是( D )
(A)碳酸氢钙溶液和氢氧化钠溶液混合:HCO3- +OH- = CO32 -+H2O
(B)醋酸钠溶液和盐酸混合:CH3COONa+H+ = CH3COOH+Na+
(C)少量金属钠放入冷水中:Na+2H2O = Na++2OH-+H2↑
(D)硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42 -+Ba2++2OH- = Cu(OH)2↓+BaSO4↓
11.在pH = 1时,可大量共存且形成无色溶液的一组离子或分子是
(A)Ca2+、CH3COOH、Br-、Na+ (B)NO3- 、Fe3+、Mg2+、SO42 -
(C)HClO、Ba2+、Na+ 、Cl- (D)K+、Cl-、Al3+、SO32 -
〔答案〕A。(本人注:选项C中,HClO会不会大量存在?)
12.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为( D )
(A)(y-2x)/a (B)(y-x)/a (C)(2y-2x)/a (D)(2y-4x)/a
13. (10分)下表为元素周期表的一部分,请回答有关问题:
IA IIA IIIA IVA VA VIA VIIA 0
2 ① ②
3 ③ ④ ⑤ ⑥ ⑦ ⑧
4 ⑨ ⑩
(1)⑤和⑧的元素符号是______和_______;
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:_______________________,________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
__________________________________________________________________________。
〔答案〕(1)Si;Ar。 (2)K;F。 (3)Al;2Al(OH)3+3H2SO4 = Al2(SO4)3+6H2O;Al(OH)3+KOH = KAlO2+2H2O。 (4)在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强。
14. (9分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
〔答案〕(1)铜(或Cu);AgNO3溶液。 (2)正, Ag++e- = Ag; Cu-2e- = Cu2+。 (3)负(Cu);正(Ag)。
15. (10分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是_________________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是_________________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
〔答案〕(1)C2H6O。 (2)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑。 (3)CH3CHO。
(4)生成的有香味的W就为酯,即:Z为CH3COOH,W为CH3COOC2H5,所以有下列反应。用十字交叉法可确定CH3CH2OH过量。设该反应的产率为a,所以有:CH3CH2OH+CH3COOH CH3COOC2H5+H2O = 解得a = 60.2% 答:略。
16. (6分)PCl5的热分解反应为:PCl5(g) PCl3(g)+Cl2(g)
(1) 写出反应的平衡常数表达式:
(2) 已知某温度下,在容积为10.0 L的密闭容器中充入2.00 mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150 mol/L。计算该温度下的平衡常数。
〔答案〕(1)K = 。 (2)K = 0.45。
17. (9分)下表是稀硫酸与某金属反应的实验数据:
实验序号 金属质量/g 金属状态 c(H2SO4)/mol·L-1 V(H2SO4)/mL 溶液温度/℃ 金属消失的时间/s
反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 36 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 20? 44 40
(本人注:实验9中,温度20,可能要改为35,温度44应该改为54)
分析上述数据,回答下列问题:
(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);
(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:___________________________________________________________________________________。
〔答案〕(1)固体反应物的表面积; 表面积越大; 1和2(或4和5)。 (2)1、3、4、6、8;或2和5。 (3)反应温度; 6和7,8和9。 (4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
18.下列分子中,所有原子都处在同一平面的是( D )
(A)环已烯 (B)丙炔 (C)乙烷 (D)苯
19.分子式为C5H10的烯烃共有(要考虑顺反异构体)( B )
(A)5种 (B)6种 (C)7种 (D)8种
20.从甜橙的芳香油中可分离得到如下结构的化合物:
(A)①② (B)②③ (C)③④ (D)①④
21. (11分)根据图示回答下列问题:
(1)写出A、E、G的结构简式:A________________,E_________________,G_______________;
(2)反应②的化学方程式(包括反应条件)是_______________________________________________,
反应④化学方程式(包括反应条件)是_______________________________________________;
(3)写出①、⑤的反应类型:①________________、⑤__________________。
〔答案〕(1)CH2=CH2, ,HOOC(CH2)4COOH。
(2)ClCH2CH2Cl+NaOH CH2=CHCl+NaCl+H2O;
ClCH2CH2Cl+2NaOH(aq) HOCH2CH2OH+2NaCl。 (3)①加成反应;⑤缩聚反应。
22.下列叙述正确的是( C )
(A)分子晶体中的每个分子内一定含有共价键 (B)原子晶体中的相邻原子间只存在非极性共价键
(C)离子晶体中可能含有共价键 (D)金属晶体的熔点和沸点都很高
23.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( D )
(A)直线形;三角锥形 (B)V形;三角锥形 (C)直线形;平面三角形 (D)V形;平面三角形
24. NaCl的晶胞如图,每个NaCl晶胞中含有的Na+离子和Cl-离子的数目分别是( C )
25. (11分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为__________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为____________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_______________________。
〔答案〕(1)N。 (2)Cl;K。 (3)Fe;1s22s22p63s23p63d64s2或[Ar]3d64s2。 (4)Cu;1s22s22p63s23p63d104s1或[Ar]3d104s1。
26.下列有关合成洗涤剂的叙述错误的是( B )
(A)在洗涤剂烷基苯磺酸钠中,烷基含碳原子的个数以12~18为宜
(B)在洗涤剂烷基苯磺酸钠中,烷基应以带有支链的为宜
(C)在合成洗涤剂中添加酶制剂可提高洗涤效果
(D)在合成洗涤剂中应以无磷助剂代替含磷助剂
27.下列有关生铁炼钢的叙述错误的是( D )
(A)添加必要的元素,改善钢材的组织结构和性能
(B)适当降低生铁中的含碳量,除去大部分硫、磷等杂质
(C)加入硅、锰、铝等合金元素调整成分并脱去钢水中的氧
(D)除去生铁中的非金属元素
28.目前下列工艺过程没有直接使用离子交换技术的是( D )
(A)硬水的软化 (B)电解饱和食盐水制备NaOH
(C)电渗析淡化海水 (D)海水中提取金属Mg
29.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________________;
(2)写出“联合制碱法”有关反应的化学方程式:_______________________________________;
______________________________________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_______________________________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%) =________________________________________。
〔答案〕(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。
(2)NH3+CO2+H2O+NaCl(饱和) = NaHCO3↓+NH4Cl; 2NaHCO3 Na2CO3+CO2↑+H2O;
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。
(4)由于总反应可看作是:2NH3+2NaCl+CO2+H2O = Na2CO3+2NH4Cl,所以:
原子利用率(%) = ×100% = ×100%;
2008年海南高考化学答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
A
B
D
C
D
B
A
C
D
B
C
13、(1)H2+SH2S
(2)H2SO3 + 2H2S=3S + 3H2O
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
或Cu+2H2SO4(浓)CuSO4 +SO2↑+2H2O等等
(4)①H2SO3+2OH—=SO32—+2H2O
②大于;题中条件中的亚硫酸溶液和氢氧化钠溶液刚好完全反应生成Na2SO3溶液,Na2SO3溶液中SO32-发生水解使溶液显碱性。
③增大;升高温度促进Na2SO3溶液的水解。
14、(1)7;K2O、K2O2(KO2也可以)
(2)He、Ne、Ar
(3)C、H
(4)Na
(5)NH3 ; SiH4
15、(1)放热
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动;
(3)不影响;催化剂不改变平衡的移动。
(4)减小、减小
16、(1)B、D、F
选择B,目的:除去空气中的水蒸气
选择D,目的:除去空气中的CO2
选择F,目的:除去空气中的O2
(2)h→g→d→c→k→l→a→b
(3)制得的氮化镁将不纯;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应生成其它物质。
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物有氮化镁。
17、(1)C5H10O
(2)HOOC—CH2—COOH,
HOOC—CH2—COOH + 2C2H5OHC2H5OOC—CH2—COOC2H5 +2H2O;
酯化反应(或取代反应)
(3)HO—CH2—CH2—CH=CH—CH3
(4)2;CH3CH2CH2COOH、CH3CH(CH3)COOH
上一篇:高考学霸高伟_高考学霸是谁